Tin tức về việc ca sĩ Lý Uyên qua đời do trầm cảm hôm qua đã khiến cả mạng xã hội chấn động, mọi người đều cảm thán và tưởng nhớ. Nhiều người khó mà chấp nhận rằng một người vui vẻ, tích cực và tràn đầy năng lượng như vậy lại không thoát khỏi cái móng vuốt của trầm cảm. Nhân loại chưa bao giờ ngừng cuộc chiến chống lại trầm cảm, từ khi phát hiện ra hợp chất đầu tiên có hiệu quả chống trầm cảm vào năm 1954, vào năm 1988, thuốc chống trầm cảm thế hệ thứ hai “Prozac” đã được phê duyệt và ra mắt, giúp đỡ vô số bệnh nhân trầm cảm, nhưng vẫn không thể thỏa mãn toàn bộ nhu cầu điều trị. Hiện tại, thuốc chống trầm cảm thế hệ thứ ba vẫn đang trong quá trình nghiên cứu phát triển. Hy vọng sức mạnh của khoa học có thể giúp đỡ tất cả những người bị trầm cảm hành hạ.
Bài viết | Từ Xử Ý
Cách đây 2500 năm, cha đẻ của y học Hy Lạp, Hippocrates và người kế nhiệm nổi tiếng Galen, đã cổ xúy lý thuyết bốn dịch thể (The Four Humors Theory) ảnh hưởng đến y học phương Tây gần hai thiên niên kỷ. Hippocrates cho rằng mỗi người có bốn loại dịch thể: máu (sanguine), mật vàng (choleric), mật đen (melancholic) và đờm (phlegmatic), sức khỏe là kết quả của sự hòa hợp giữa các dịch thể này; nếu dịch thể pha trộn sai sẽ dẫn đến bệnh tật, và nguyên lý điều trị là làm cho dịch thể phục hồi lại trạng thái hài hòa. Galen đã áp dụng lý thuyết bốn dịch thể vào lâm sàng phân loại tính cách con người thành bốn loại: người có dịch thể mật vàng thì dũng cảm, năng động; người có dịch thể mật đen thì cứng đầu và u sầu; người có dịch thể đa huyết thì nhiệt tình và quyết đoán; người có dịch thể đờm thì ngu ngốc và lười biếng. Galen còn phân loại viêm thành bốn loại: viêm xuất phát từ máu, viêm từ mật vàng, phù nề từ đờm, và khối u từ mật đen. Ông thậm chí đã sử dụng lý thuyết này để phân loại sốt: sốt kéo dài thuộc về máu, sốt ba ngày thuộc về mật vàng, sốt hằng ngày thuộc về đờm, sốt bốn ngày thuộc về mật đen.

Hình 1. Đoạn về lý thuyết bốn dịch thể trong tác phẩm “Bản chất con người” của Hippocrates. Nguồn: Jones, W.H.S. (1931) Hippocrates, Volume IV: Nature of Man.
Galen có thể được coi là đỉnh cao của sự phát triển y học Hy Lạp, các thầy thuốc sau đó chỉ có thể chú thích hoặc biên soạn lý thuyết của Galen và y học cổ đại. Giống như “Hoàng đế nội kinh” và “Thương hàn tạp bệnh luận” đã thống trị và kiềm chế sự phát triển của y học cổ truyền, y học phương Tây trong hai thiên niên kỷ tiếp theo không có sự đổi mới nào. Giả thuyết y học thu được từ lâm sàng và thực nghiệm của Galen và Hippocrates đã trở thành sự thật tuyệt đối thay thế cho sự thực, cho đến khi quá trình phục hưng, giải phẫu học mới và tế bào học đã thay thế lý thuyết bốn dịch thể đã lỗi thời. Ngày nay, mặc dù y học phương Tây không còn nói về lý thuyết dịch thể, nhưng chúng ta vẫn thấy thuật ngữ “melancholia” trong các sách giáo khoa y học, điều này không nghi ngờ gì là di sản của lý thuyết bốn dịch thể. Tiếng Hy Lạp melam có nghĩa là “đen”, choleria có nghĩa là “mật”, melancholia (cũng có thể được viết là melancholy hoặc melencolia) chỉ bệnh do quá nhiều mật đen gây ra, nó thực sự mô tả chứng trầm cảm đang làm phiền khoảng 15% dân số thế giới ngày nay.

Hình 2. Tác phẩm nổi tiếng “Tôi trong nỗi buồn” (Melencolia I) của nghệ sĩ Đức Dürer, sáng tác năm 1514.
Trầm cảm là một rối loạn tâm lý, còn gọi là rối loạn tâm thần cảm xúc hay bệnh tâm thần cảm xúc, là một nhóm triệu chứng cảm xúc với đặc trưng chính là tâm trạng trầm cảm rõ rệt, thường đi kèm với các thay đổi tư duy và hành vi tương ứng. Bệnh nhân trầm cảm có những trải nghiệm nội tâm đau đớn, họ là “những người rất tiêu cực và buồn bã”. Tiêu chuẩn chẩn đoán trầm cảm do Hiệp hội Tâm thần Hoa Kỳ đưa ra yêu cầu trong cùng một khoảng thời gian hai tuần, bệnh nhân gần như mỗi ngày đều thể hiện ít nhất năm trong chín triệu chứng phổ biến sau:
(1) Tâm trạng u buồn;
(2) Mất hứng thú với hầu hết các hoạt động hàng ngày;
(3) Cân nặng giảm hoặc tăng rõ rệt;
(4) Mất ngủ hoặc ngủ quá nhiều;
(5) Kém hoạt động tâm lý hoặc lo âu;
(6) Mệt mỏi và thiếu năng lượng;
(7) Tư duy tiêu cực và tự phủ nhận hoàn toàn bản thân;
(8) Giảm chức năng não hoặc do dự bất thường;
(9) Tư tưởng tự sát thường xuyên xuất hiện.
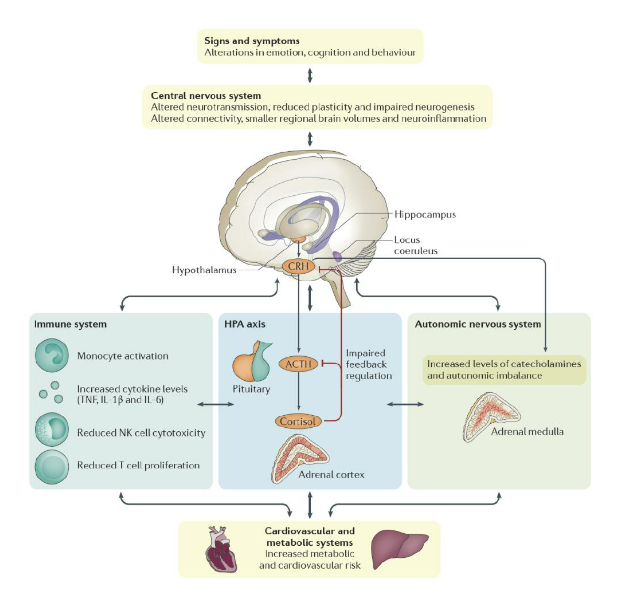
Hình 3. Sinh lý học bệnh lý của trầm cảm liên quan đến nhiều hệ thống trong cơ thể.
Mặc dù trầm cảm là một căn bệnh về cảm xúc trong hệ thần kinh trung ương, nhưng sinh lý bệnh lý của nó cũng liên quan đến một số hệ thống sinh lý khác trong cơ thể, bao gồm hệ miễn dịch, hệ thần kinh nội tiết tham gia vào phản ứng ứng lực (chủ yếu là trục Hypothalamus – Tuyến yên – Tuyến thượng thận), hệ thống thần kinh tự chủ ngoại vi, cùng với hệ tim mạch và hệ thống chuyển hóa. Bởi vì những hạn chế của nhiều mô hình động vật trầm cảm, nghiên cứu sinh học thần kinh đến nay vẫn chưa làm rõ cơ chế tương tác giữa các hệ thống này trong quá trình phát bệnh.
Trùng hợp và Khám Phá: Thuốc chống trầm cảm thế hệ đầu tiên
Mặc dù trầm cảm đã được ghi chép về thiệt hại sức khỏe của nó từ thời kỳ Hy Lạp cổ đại, nhưng cho đến gần đây, các phương pháp hiện đại để điều trị các loại bệnh tâm thần vẫn rất hạn chế. Hợp chất đầu tiên có hiệu quả chống trầm cảm Iproniazid chỉ được phát hiện tình cờ vào năm 1954 bởi một số bác sĩ lâm sàng nghiên cứu bệnh phổi. Chất ức chế monoamine oxidase (MAOI) này ban đầu được sử dụng nhằm thử nghiệm điều trị bệnh lao phổi, thử nghiệm lâm sàng không thấy hiệu quả, nhưng bất ngờ phát hiện rằng Iproniazid có “tác dụng phụ” là làm tăng năng lượng của bệnh nhân. Thật không may, sau một thời gian ngắn sử dụng thành công trong thử nghiệm lâm sàng và được sử dụng rộng rãi cho bệnh nhân trầm cảm, Iproniazid đã buộc phải ngừng sử dụng vì phát hiện có độc tính gan. May mắn thay, thuốc chống trầm cảm thứ hai được phát triển dựa trên ý tưởng MAOI là Imipramine nhanh chóng thành công vào năm 1957 và đây là một hợp chất có cấu trúc ba vòng. Imipramine có hiệu quả với 60% đến 70% bệnh nhân trầm cảm, và cho đến nay vẫn là một trong những phương pháp điều trị của bác sĩ tâm thần.
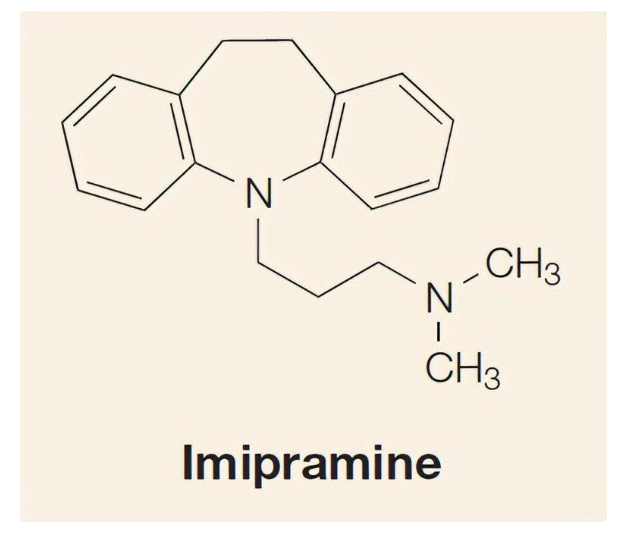
Hình 4. Nguyên mẫu của thuốc chống trầm cảm ba vòng: Imipramine.
Kinh nghiệm truyền thống trong ngành dược cho thấy, nhiều loại thuốc được phát hiện tình cờ thường có cơ chế tác động phức tạp và có nhiều tác dụng phụ độc hại. Người bệnh sử dụng thuốc chống trầm cảm thế hệ đầu thường đi kèm với các tác dụng phụ không mong muốn như nhịp tim nhanh và không đều, miệng khô, táo bón, hạ huyết áp khi thay đổi tư thế, buồn ngủ, v.v. Vì vậy, các nhà khoa học tiếp tục tổng hợp và sàng lọc các hợp chất tương tự Iproniazid và Imipramine với hy vọng làm giảm những tác dụng phụ này.
Đồng thời, các nhà nghiên cứu y học cơ bản cũng đang nghiên cứu sâu hơn về cơ chế tác dụng của các loại thuốc này. Kể từ cuối những năm 1950, đã có nhiều nghiên cứu hóa học thần kinh liên quan đến trầm cảm mang lại kỹ thuật tiên tiến, dẫn đến việc phát hiện ra norepinephrine và dopamine, hai loại neurotransmitter monoamine mới. Các nhà khoa học đại diện như Julius Axelrod và Ulf von Euler đã giành giải Nobel Sinh lý học hoặc Y học vào năm 1970, còn Arvid Carlsson thì nhận giải Nobel vào năm 2000.
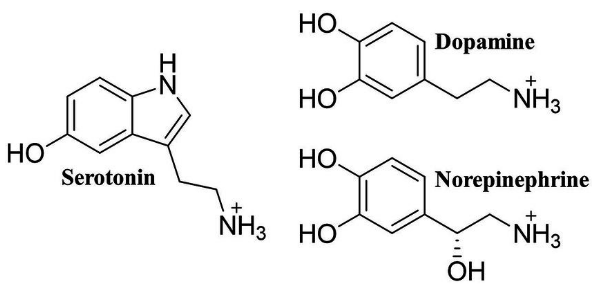
Hình 5. Ba neurotransmitter monoamine quan trọng nhất: Serotonin, Dopamine, Norepinephrine.
Trong điều kiện sinh lý bình thường, để neuron sau synapse liên tục tiếp nhận được xung điện từ neuron trước synapse, các neurotransmitter đã được giải phóng từ neuron trước synapse cần phải được loại bỏ kịp thời và hiệu quả khỏi khe synapse sau khi hoàn tất việc truyền bên tín hiệu. Do tốc độ khuếch tán của neurotransmitter ra khỏi khe synapse rất chậm, hệ thần kinh còn có hai cơ chế nhanh để loại bỏ neurotransmitter, hoặc là dùng enzyme chuyển hóa đặc hiệu trong khe synapse để phân hủy tại chỗ (ví dụ MAO là enzym chịu trách nhiệm phân hủy các neurotransmitter monoamine), hoặc là thu hồi thông qua các protein vận chuyển đặc hiệu trên màng tế bào của neuron trước synapse hoặc tế bào thần kinh đệm.
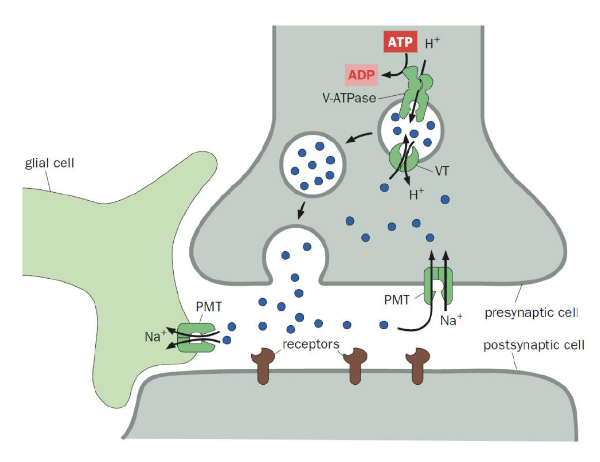
Hình 6. Neuron trước synapse và tế bào thần kinh đệm thu hồi neurotransmitter dư thừa từ khe synapse. Nguồn: Luo, L. (2020) Principles of Neurobiology, 2nd Edition.
Trong điều kiện bệnh lý của trầm cảm, hiệu quả truyền tín hiệu ở neuron sau synapse liên quan đến các neurotransmitter điều chỉnh cảm xúc có thể bị suy giảm, có thể không cần phải nhanh chóng loại bỏ chúng khỏi khu vực synapse. Các nghiên cứu tiếp theo theo hướng này đã phát hiện ra rằng MAOI và thuốc chống trầm cảm ba vòng (TCA) đều có thể nâng cao nồng độ hiệu quả của neurotransmitter monoamine trong khe synapse. MAOI có thể ức chế hoạt động của enzyme MAO có trách nhiệm phân hủy neurotransmitter monoamine trong khe synapse, trong khi TCA thì ức chế hệ thần kinh thu hồi norepinephrine và serotonin (5-HT, còn gọi là Serotonin). Điều này khiến các nhà khoa học tin rằng một cơ chế gây bệnh chính của trầm cảm là nồng độ neurotransmitter monoamine có thể sử dụng trong não bệnh nhân giảm xuống rõ rệt, lý thuyết này được gọi là “giả thuyết monoamine của trầm cảm.”
Sinh ra khó khăn: Thuốc chống trầm cảm thế hệ thứ hai
Giả thuyết monoamine của trầm cảm vào đầu những năm 1970 đã thúc đẩy sự ra đời của thuốc chống trầm cảm thế hệ thứ hai thành công. Các thử nghiệm về Imipramine và hai loại TCA chứa nhóm amine bậc ba khác (Amitriptyline và Chlomipramine) cho thấy chúng ức chế hồi thu serotonin cao hơn gấp nhiều lần so với norepinephrine. Trong khi đó, các thuốc TCA chứa nhóm amine bậc hai như Desipramine, Nortriptyline và Desmethylchlomipramine lại có tính chọn lọc ngược lại, hiệu quả hơn trong việc ức chế hồi thu norepinephrine. Do đó, phòng thí nghiệm của Carlson đã đề xuất một giả thuyết phân loại hiệu quả của TCA, họ cho rằng việc ức chế hồi thu serotonin có thể nâng cao tâm trạng của bệnh nhân, trong khi việc ức chế hồi thu norepinephrine có thể nâng cao sự quan tâm và động lực của bệnh nhân đối với các hoạt động hàng ngày.
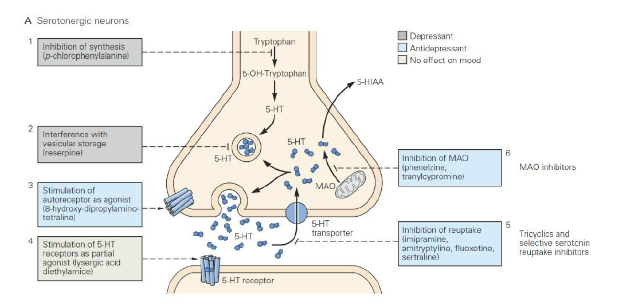
Hình 7. Cơ chế tác động chống trầm cảm của thuốc ức chế hồi thu serotonin. Nguồn: Kandel, E.R. et al (2021) Principles of Neural Science, 6th Edition.
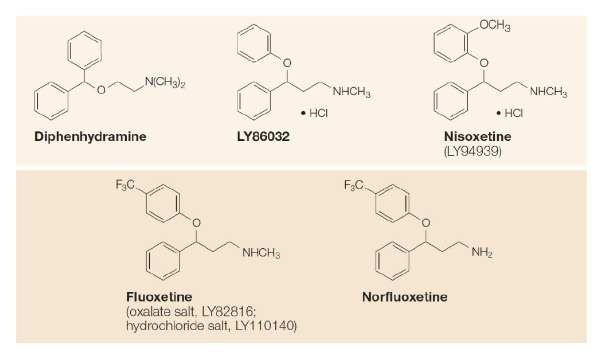
Bắt đầu từ năm 1971, các nhà nghiên cứu của công ty Eli Lilly đã bắt đầu tập trung vào việc phát triển thuốc ức chế hồi thu có chọn lọc (SRI) thần kinh truyền dẫn có tính năng đặc hiệu hơn so với các thuốc TCA, thông qua việc phân biệt giữa các hệ thống neurotransmitter monoamine khác nhau để tăng cường độ an toàn của thuốc chống trầm cảm và sự chịu đựng của bệnh nhân đối với thuốc. Họ đã tổng hợp một hợp chất amine bậc hai tên là Nisoxetine (LY94939), trong thí nghiệm tế bào sinh hóa in vitro, nó có thể ức chế chọn lọc cao norepinephrine.
Vào năm 1972, họ lại thực hiện sửa đổi hóa học đối với một trong hai vòng benzen của Nisoxetine, và bất ngờ phát hiện ra rằng: khi gắn nhóm trifluoromethyl vào đối vị, hợp chất amine bậc hai mới tạo ra Fluoxetine là một chất ức chế hồi thu serotonin có chọn lọc mạnh! Điều này cho thấy “quy tắc amine bậc ba” phát hiện ra trong TCA không áp dụng cho các hợp chất được tạo thành từ hai vòng benzen, và nhóm trifluoromethyl đóng vai trò quan trọng; nếu thay thế bằng nhóm methyl, methoxy hoặc đơn giản là halogen, thì hiệu quả ức chế hồi thu serotonin sẽ giảm đi. Ngược lại, nếu nhóm trifluoromethyl được di chuyển đến vị trí lân cận hoặc vị trí trung gian, điều đó có thể tăng hiệu quả ức chế hồi thu norepinephrine nhưng lại làm giảm hiệu quả ức chế hồi thu serotonin.
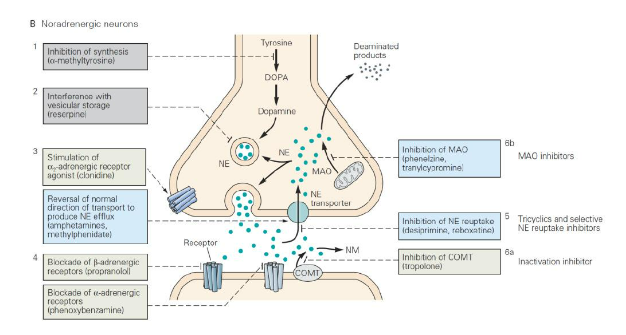
Hình 8. Cơ chế tác động chống trầm cảm của thuốc ức chế hồi thu norepinephrine. Nguồn: Kandel, E.R. et al (2021) Principles of Neural Science, 6th Edition.
Sau đó, các thử nghiệm dược lý động vật đã xác nhận tính chọn lọc trong việc ức chế hồi thu serotonin của Fluoxetine, nên vào năm 1974, các nhà nghiên cứu của công ty Eli Lilly quyết định công bố kết quả thí nghiệm này trong tài liệu, Fluoxetine trở thành thuốc SSRI đầu tiên được báo cáo chính thức. Họ cho rằng Fluoxetine không chỉ là một thuốc hữu ích để nghiên cứu sinh lý thần kinh và các quá trình nội tiết của serotonin mà còn có thể trở thành một loại thuốc chống trầm cảm mới.
Quan điểm này đã khiến một số chuyên gia trong giới học thuật nghi ngờ và chỉ trích, bởi vào thời điểm đó, Fluoxetine không cho thấy hiệu quả rõ rệt tương tự như thuốc TCA trong các mô hình động vật chống trầm cảm thông dụng (như thí nghiệm bơi cưỡng bức trên chuột). Các chuyên gia rất tin tưởng rằng việc ức chế hồi thu norepinephrine là điều quan trọng hơn trong điều trị trầm cảm, họ không thể tưởng tượng nổi một chất ức chế hồi thu serotonin gần như chuyên biệt sẽ có thể làm thuốc chống trầm cảm lâm sàng. Hơn nữa, có những ý kiến cực đoan cho rằng, việc tăng cường truyền tín hiệu thần kinh của serotonin có thể làm trầm trọng thêm triệu chứng trầm cảm của bệnh nhân.
Hình 9. Công ty Eli Lilly phát triển thuốc mới Fluoxetine qua quy trình tối ưu hóa hóa học dược phẩm, chính là ngày nay rất nổi tiếng với tên gọi Prozac.
May mắn thay, ban lãnh đạo công ty Eli Lilly vào đầu những năm 1970 rất có tinh thần tiên phong và dám nghĩ dám làm, họ vẫn quyết định thành lập dự án phát triển sản phẩm Fluoxetine. Công ty đầu tiên tiến hành thử nghiệm độc tính trên chuột và chó, kết quả rất nhanh đã phát hiện thuốc có biểu hiện tích tụ phospholipid trong tế bào, điều này thường gặp trong lĩnh vực độc lý học ngày nay. Các nhà độc học năm đó đang trong tình trạng không biết cách đánh giá độc tính có thể do tích tụ phospholipid gây ra, vì vậy đội ngũ của công ty Eli Lilly phải tạm ngừng dự án Fluoxetine để thảo luận các đối sách.
Chín tháng sau, các nhà khoa học của Eli Lilly đã đến tham vấn ý kiến từ các chuyên gia tại Bộ Thần kinh học FDA Hoa Kỳ, họ đã biết rằng nhiều phân tử ion âm amiphiphilic đều có thể gây ra tích tụ phospholipid có thể đảo ngược. Một tin tốt cho các dự án phát triển của công ty Eli Lilly là nhiều loại thuốc đã được phê duyệt trên thị trường có thể gây ra tích tụ phospholipid ở động vật nhưng không ghi nhận tác dụng phụ độc hại trên người. Vì vậy, dự án phát triển Fluoxetine được khởi động lại và bắt đầu thử nghiệm lâm sàng giai đoạn một về tính an toàn của thuốc từ năm 1976, bệnh nhân đối với liều lượng Fluoxetine có tính chịu đựng rất khả quan.
Tuy nhiên, thử nghiệm lâm sàng giai đoạn hai liên quan đến tính hiệu quả của Fluoxetine đã gặp phải nhiều rắc rối lớn. Lúc đó Fluoxetine không phải là dự án trọng điểm của công ty Eli Lilly, do đó số lượng bệnh nhân tình nguyện không đủ, và công ty thiếu một nhà lãnh đạo có kinh nghiệm lâm sàng trong lĩnh vực phát triển thuốc điều trị bệnh tâm thần. Kết quả Fluoxetine không cho thấy hiệu quả rõ ràng khi được sử dụng trên một nhóm bệnh nhân trầm cảm quy mô nhỏ. Các nhà khoa học của Eli Lilly trong cảm giác thất vọng sâu sắc đã tham khảo ý kiến từ một số chuyên gia, phát hiện trong nhóm bệnh nhân này có nhiều người không phản ứng với thuốc chống trầm cảm thế hệ đầu tiên. Vì vậy, đội ngũ của Eli Lilly quyết định không từ bỏ, trong hơn hai năm tiếp theo thay đổi một nhóm bệnh nhân để thực hiện thử nghiệm lâm sàng giai đoạn hai tốn kém. Đây cũng là cơ hội cuối cùng cho toàn bộ dự án Fluoxetine, “khổ tâm không phụ lòng người”, thử nghiệm lần này đã thu được hiệu quả lâm sàng hài lòng, điều này chứng minh tầm quan trọng của thiết kế thí nghiệm hợp lý được hướng dẫn bằng thống kê trước khi thử nghiệm lâm sàng. Đội ngũ Eli Lilly nhanh chóng tiếp tục đẩy mạnh xác minh hiệu quả trong thử nghiệm lâm sàng giai đoạn ba quy mô lớn, và kết quả cũng rất khả quan. Họ phát hiện ra rằng Fluoxetine có tác dụng phụ lâm sàng thấp hơn đáng kể so với các thuốc TCA, với các tác dụng không mong muốn như miệng khô, chóng mặt, táo bón và buồn ngủ ở bệnh nhân nhẹ hơn. Năm 1983, hơn 100 cuộn tài liệu, mỗi cuộn dày tới hai inch của dữ liệu thử nghiệm lâm sàng cuối cùng từ công ty Eli Lilly ở Indiana, Hoa Kỳ đã được chuyển tới Bộ phê duyệt thuốc mới của FDA tại Washington, đây đã là bảy năm kể từ khi thử nghiệm trên người đầu tiên của Fluoxetine, sự gian khổ trong việc phát triển một loại thuốc mới đã rõ ràng.
Bốn năm sau, vào kỳ nghỉ lễ Giáng sinh, tức là ngày 29 tháng 12 năm 1987, các thành viên trong đội ngũ Eli Lilly cuối cùng đã biết tin vui về việc Fluoxetine được FDA phê duyệt qua các bản tin truyền hình. Sau hơn mười năm đấu tranh gian khổ, trong niềm xúc động, mọi người cũng có cảm giác được “xét xử lại”. Trong thời gian dài, dự án này của công ty Eli Lilly không được nhiều người đánh giá cao, thậm chí một số người trong ngành đã chế giễu. Vào tháng 1 năm 1988, Fluoxetine được thương mại hóa với tên gọi “Prozac” tại Mỹ, thị phần nhanh chóng vượt qua các thuốc chống trầm cảm TCA. Đến năm 1992, doanh thu của Prozac chỉ riêng trên thị trường Mỹ đã vượt quá một tỷ đô la.
Là thuốc SSRI đầu tiên ra mắt trên thị trường, thành công to lớn mà Prozac đạt được đã thu hút nhiều công ty dược phẩm khác bắt chước theo cách tương tự. Zoloft của công ty Pfizer đã trở thành thuốc SSRI thứ hai ra mắt thị trường vào năm 1992. Rất nhanh chóng, nhiều loại SSRI mới lại xuất hiện, trở thành thuốc chống trầm cảm thế hệ thứ hai dẫn đầu thị trường cho đến ngày nay. Năm 1999, Prozac – “người đại diện hàng đầu” của các loại thuốc SSRI đã được tạp chí Forbes vinh danh là “Sản phẩm của thế kỷ”. Thành công của các thuốc chống trầm cảm thế hệ thứ hai không thể so sánh được với những gì thuốc tiên phong thế hệ đầu tiên TCA đạt được.
Chặng đường dài: Hướng phát triển thuốc chống trầm cảm thế hệ thứ ba
Với việc sử dụng rộng rãi của các thuốc chống trầm cảm thế hệ thứ hai, những hạn chế và vấn đề mới cũng bắt đầu thu hút sự chú ý rộng rãi từ các bác sĩ lâm sàng. Khoảng 20% đến 30% bệnh nhân trầm cảm sau khi trải qua ít nhất hai phương pháp điều trị bằng thuốc chống trầm cảm khác nhau vẫn không có hiệu quả, họ được phân loại là trầm cảm kháng trị (treatment-resistant depression, TRD), tỉ lệ nhập viện và nguy cơ tự sát cao hơn nhiều so với bệnh nhân thông thường. Một số bệnh nhân dù đã có hiệu quả khi dùng thuốc SSRI nhưng cũng có thể tái phát. Hơn nữa, các thuốc chống trầm cảm SSRI như Prozac vẫn còn một bí ẩn chưa được giải đáp: mặc dù trong vòng vài giờ sau khi uống thuốc, nồng độ serotonin trong máu đã tăng rõ rệt, nhưng mà phải dùng thuốc liên tục trong vài tuần hoặc thậm chí hàng tháng sau mới thấy triệu chứng trầm cảm thuyên giảm. Sự chậm trễ trong hiệu quả cho thấy cơ chế chống trầm cảm của SSRI rất phức tạp, không chỉ dựa vào việc nâng cao nồng độ serotonin trong khe synapse.
Bắt đầu từ những năm 1990, những hạn chế của giả thuyết monoamine về trầm cảm đã ngày càng nổi bật. Một số nhà khoa học bắt đầu suy diễn rằng bệnh lý trầm cảm có thể còn liên quan đến các đường dẫn nội tại của các neuron trong vỏ não và hệ limbic, mà các neuron trong những đường dẫn này chủ yếu giải phóng hai loại neurotransmitter: glutamate (Glu) và acid gamma-aminobutyric (GABA). Glutamate là neurotransmitter kích thích quan trọng nhất trong não, đóng vai trò quan trọng trong xử lý thông tin, học tập, trí nhớ và tính dẻo của thần kinh. Quá trình neuron trước synapse giải phóng glutamate có thể được điều chỉnh âm tính thông qua thụ thể GABA (GABAR).
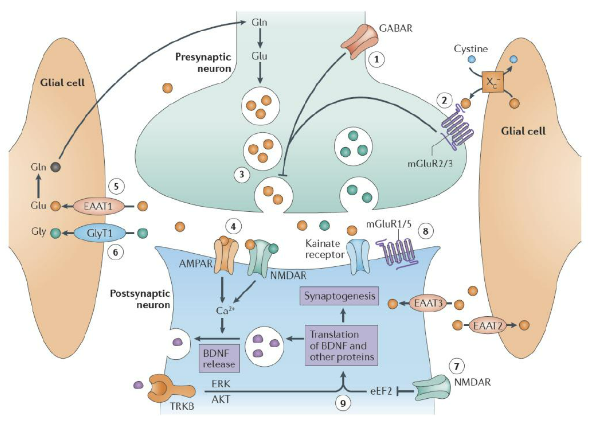
Hình 10. Quá trình truyền dẫn tín hiệu của glutamate và GABA dưới điều kiện sinh lý.
Hệ thống thụ thể của glutamate khá phức tạp, có thể chia thành hai loại lớn: (1) thụ thể ion (ionotropic receptors), chủ yếu bao gồm thụ thể NMDA (NMDAR), thụ thể AMPA (AMPAR), thụ thể kainate; (2) thụ thể chuyển hóa (metabotropic receptors, mGluRs).
Cuối những năm 1990, đã có nghiên cứu cho thấy các chất ức chế thụ thể NMDA có tác dụng chống trầm cảm trong các mô hình động vật. Và ngay từ năm 1970, thuốc gây mê ketamine đã được FDA phê duyệt sử dụng, thực tế chính là một chất ức chế thụ thể NMDA hiệu quả. Mặc dù ketamine dễ bị lạm dụng, để lại tiếng xấu là ma túy “K”, các nhà khoa học tại Đại học Yale vẫn quyết định thực hiện thử nghiệm lâm sàng mù đôi với ketamine liều nhỏ trên 7 bệnh nhân trầm cảm. Điều bất ngờ là, những bệnh nhân này đã cải thiện rõ rệt cảm xúc tiêu cực trong vòng vài giờ sau khi tiêm tĩnh mạch, và tác dụng kéo dài có thể duy trì trong nhiều ngày. Sáu năm sau, các học giả tại Viện Nghiên cứu sức khỏe tâm thần Quốc gia Hoa Kỳ đã phát hiện ra rằng tiêm liều đơn ketamine cũng có hiệu quả nhanh chóng và kéo dài đối với các bệnh nhân trầm cảm kháng trị.
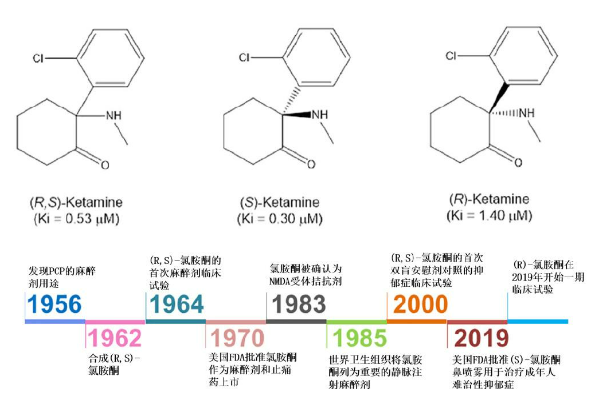
Hình 11. Lịch sử phát triển của ketamine từ thuốc gây mê đến thuốc chống trầm cảm.
Để phát triển loại thuốc có thể mang lại lợi ích cho bệnh nhân trầm cảm kháng trị từ loại thuốc gây mê dễ bị lạm dụng này, công ty Johnson & Johnson đã bỏ ra rất nhiều công sức, lần lượt thực hiện 19 thử nghiệm lâm sàng giai đoạn một, 4 thử nghiệm giai đoạn hai và 5 thử nghiệm giai đoạn ba với dạng xịt mũi ketamine (S)-enantiomer (esketamine). Vào tháng 3 năm 2019, ủy ban chuyên gia FDA đã xem xét kết quả của 3 cuộc thử nghiệm giai đoạn ba thành công và 2 cuộc thất bại, sau nhiều năm không có thuốc chống trầm cảm có cơ chế mới xuất hiện trong hơn 30 năm, cuối cùng bằng 14 phiếu thuận, 2 phiếu phản đối và 1 phiếu không tham gia, quyết định phê duyệt eskedamine ra thị trường, với tên gọi thương mại là Spravato. FDA quy định, Spravato phải được kết hợp với các loại thuốc chống trầm cảm khác uống bằng đường miệng, giới hạn cho bệnh nhân trầm cảm kháng trị ở người lớn. Hơn nữa, do sản phẩm này có các tác dụng phụ nghiêm trọng như buồn ngủ quá mức, ảo giác phân ly, dễ nghiện, cần phải thông qua các kênh phân phối đặc biệt (Rủi ro Đánh giá và Giảm thiểu Chiến lược, REMS) để có được, kèm theo cảnh báo đặc biệt.
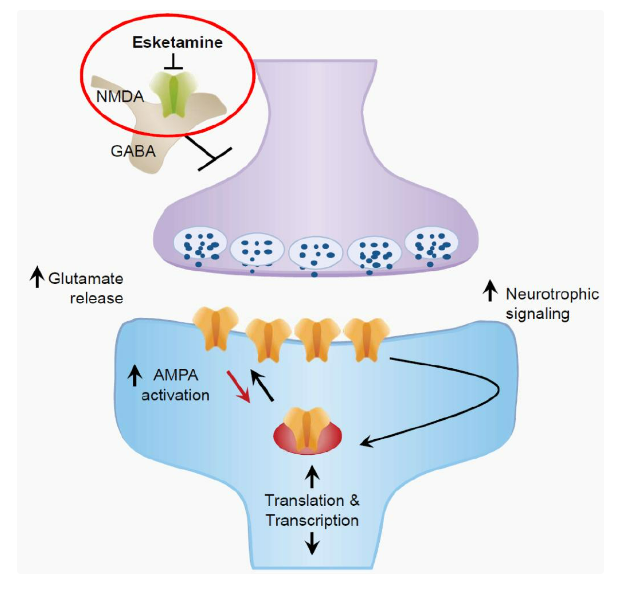
Hình 12. Cơ chế tác dụng của ketamine và eskedamine với trầm cảm.
Cơ chế phân tử tổng quát của eskedamine là: thông qua việc ức chế thụ thể NMDA của glutamate, nó khuyến khích sự giải phóng glutamate, kích hoạt thụ thể AMPA ở neuron sau synapse. Sự kích hoạt thụ thể AMPA có thể tăng cường hồi tiếp tín hiệu của các yếu tố dinh dưỡng thần kinh, tạo ra hiệu quả chống trầm cảm nhanh chóng và kéo dài. Nhưng những hiểu biết ban đầu này còn xa mới giúp chúng ta hiểu rõ về cơ chế hoạt động của ketamine. Gần đây, nhiều nhóm nghiên cứu đã đi sâu vào tìm hiểu nhằm tìm ra các loại thuốc mới có thể loại trừ những tác dụng phụ bất lợi của eskedamine. Hiện tại ít nhất đã có năm giả thuyết khác nhau, và giới học thuật khó có thể đạt được sự đồng thuận toàn diện trong thời gian ngắn. Tóm lại, việc phát triển thuốc chống trầm cảm liên quan đến sức khỏe con người vẫn còn rất nhiều thách thức.
Tài liệu tham khảo
[1] Otte, C. et al. (2016) Nature Reviews Disease Primers 2: 16065.
[2] Wong, D.T., Bymaster, F.P. & Engleman, E.A. (1995) Life Sciences 57: 411-441.
[3] Stokes, P.E. & Holtz, A. (1997) Clinical Therapeutics 19: 1135-1250.
[4] Wong, M.L. & Licinio, J. (2004) Nature Reviews Drug Discovery 3: 137-151.
[5] Wong, D.T., Perry, K.W. & Bymaster, F.P. (2005) Nature Reviews Drug Discovery 4: 764-774.
[6] Murrough, J.W., Abdallah, C.G. & Mathew, S.J. (2017) Nature Reviews Drug Discovery 16: 472-486.
[7] Wei, Y., Chang, L. & Hashimoto, K. (2020) Pharmacology, Biochemistry and Behavior 190: 172870.
[8] Yavi, M. et al. (2022) Discover Mental Health 2: 9.
Sản phẩm: Khoa học phổ biến Trung Quốc – Dự án Ngôi sao.
Thông báo bản quyền: Hoan nghênh cá nhân chia sẻ, bất kỳ dạng phương tiện hoặc tổ chức nào chưa được cấp phép không được sao chép và biên tập lại. Để xin phép sao chép vui lòng liên hệ qua WeChat chính thức của “Phản phác”.